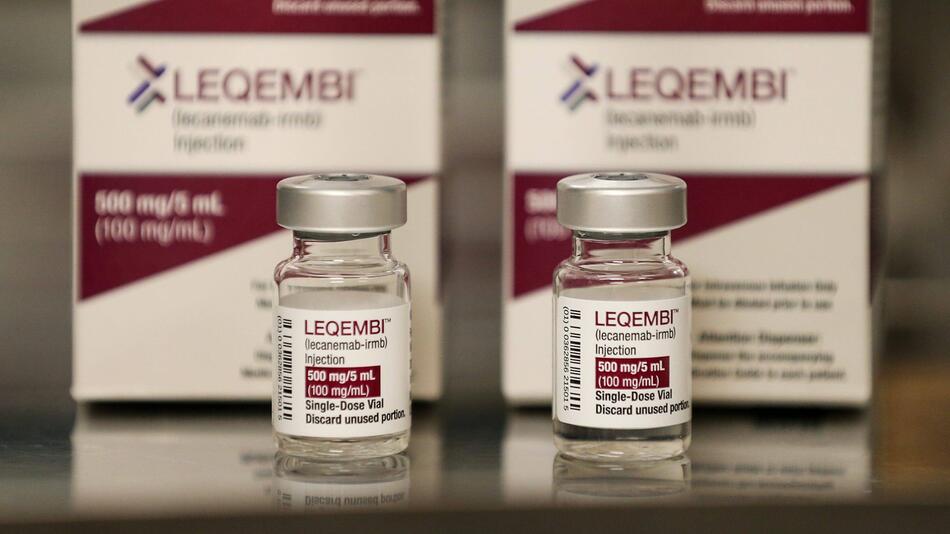In mehreren Ländern werden Alzheimer-Patienten bereits mit dem Medikament Lecanemab behandelt, es ist das erste seiner Art. Die EU-Arzneimittelbehörde sprach sich nun jedoch gegen eine Zulassung aus – aus Sicht vieler Fachärzte in Deutschland ein herber Rückschlag.
Auf dem Wirkstoff Lecanemab ruhen grosse Hoffnungen. Er ermöglicht die erste Alzheimer-Therapie, die nicht nur leichten Einfluss auf Symptome nimmt, sondern die Ursache angeht. Bereits verkauft wird er als Medikament mit dem Namen Leqembi in Japan, China und den USA, zugelassen ist er ausserdem in Südkorea, Hongkong und Israel, wie das Unternehmen Eisai mitteilt, das den Antrag auf Zulassung für die EU gestellt hatte.
Doch die EU-Arzneimittelbehörde EMA sprach sich gegen die Zulassung aus. Das Risiko schwerer Nebenwirkungen des Antikörpers sei höher zu bewerten als die erwartete positive Wirkung, teilte die EMA in Amsterdam mit. Dabei verwies die Behörde insbesondere auf mögliche Wassereinlagerungen und Blutungen im Gehirn von Menschen, die mit dem Präparat behandelt werden – obwohl die meisten Fälle in der Hauptstudie nicht schwerwiegend gewesen seien, wie die EMA einräumte.
Für wen käme Lecanemab in Frage?
Bei Lecanemab handelt es sich um einen Antikörper, der sich gegen Ablagerungen aus dem Protein Beta-Amyloid richtet, die als Ursache für Alzheimer gelten. In den USA werden schon seit Anfang 2023 Alzheimer-Patienten im Frühstadium damit behandelt.
Was ist Alzheimer?
- Alzheimer ist die häufigste Form von Demenz. Nach aktuellen Hochrechnungen leben in Deutschland zurzeit rund 1,8 Millionen Menschen mit Demenz. Der Grossteil von ihnen ist von der Alzheimer-Krankheit betroffen. Sie ist nach dem deutschen Neurologen Alois Alzheimer (1864-1915) benannt, der sie als Erster wissenschaftlich beschrieb. Zwar ist die Ursache der Erkrankung bislang nicht genau geklärt, der Hauptverdacht richtet sich aber gegen das Proteinfragment Beta-Amyloid (Ass), das im Gehirn zwischen Nervenzellen Ablagerungen bildet, sogenannte Plaques. Diese führen zu einer Kaskade an Hirnveränderungen, die letztlich die Nervenzellen schädigen und zu Demenz führen. Meist schreitet die Erkrankung langsam voran. Zu den Symptomen gehören Gedächtnis- und Orientierungsstörungen, Sprachstörungen, Störungen des Denk- und Urteilsvermögens sowie Veränderungen der Persönlichkeit.
Die Therapie mit Lecanemab kann bereits bestehende Symptome zwar nicht mehr beeinflussen, aber den Krankheitsverlauf im frühen Stadium verlangsamen – Studien zufolge um etwa 30 Prozent. Infrage käme der Antikörper somit für den begrenzten Kreis von Alzheimer-Patienten im Frühstadium, nach Einschätzung von Experten wären das knapp zehn Prozent.
"Als Wissenschaftler, der seit Jahrzehnten die Rolle von Amyloid-Proteinen bei der Entstehung von Alzheimer erforscht, bin ich persönlich entsetzt."
Für viele Patienten schliesst sich das Therapiefenster
"Als Wissenschaftler, der seit Jahrzehnten die Rolle von Amyloid-Proteinen bei der Entstehung von Alzheimer erforscht, bin ich persönlich entsetzt über die Entscheidung der EMA", reagierte Christian Haass, Sprecher des Münchner Standorts des DZNE (Deutsches Zentrum für Neurodegenerative Erkrankungen) und Biochemiker an der Ludwig-Maximilians-Universität München, auf die Entscheidung der EMA.
Lesen Sie auch
Lecanemab reduziere nicht nur die Amyloid-Ablagerungen im Gehirn, die sogenannten Plaques, die eine zentrale Rolle bei der Alzheimer-Erkrankung spielen, "sondern gleichzeitig auch weitere krankhafte Veränderungen wie Ansammlungen eines weiteren Proteins namens Tau im Gehirn und das Absterben von Nervenzellen."
Das bedeutet: Die täglichen Aktivitäten von Patientinnen und Patienten verbesserten sich um bis zu 38 Prozent, die Betroffenen könnten ihren Alltag also besser bewältigen. "Durch die Ablehnung der Zulassung schliessen sich jetzt endgültig Therapiefenster von zahllosen Patientinnen und Patienten in Europa, die durch diese Immuntherapie wertvolle Zeit und Lebensqualität gewonnen hätten."
"Alzheimer ist eine globale Pandemie."
Alzheimer sei eine "globale Pandemie", sagte Pierluigi Nicotera, wissenschaftlicher Vorstand und Vorstandsvorsitzender des DZNE. "In den USA, Japan und weiteren Ländern, die der Zulassung zugestimmt haben, steht der dringende, bislang unerfüllte Bedarf von Betroffenen nach neuen Therapiemöglichkeiten deutlich im Vordergrund. Lecanemab ist wirksam, wenn es in sehr frühen Stadien der Alzheimer-Krankheit verabreicht wird." Den europäischen Patienten hingegen, die sich jetzt im idealen Zeitfenster für eine Behandlung mit dem Medikament befänden, entgehe diese Therapiechance nun, so Nicotera.
Ärzte befürchten Zweiklassenmedizin
Zu den möglichen Nebenwirkungen des Medikaments können Mikroblutungen und Ödeme im Gehirn zählen. Daher muss eine Therapie regelmässig mit Untersuchungen per Kernspin (MRT) kontrolliert werden. Der zuständige Ausschuss der EMA entschied nach Mitteilung der Behörde, "dass der beobachtete Effekt des Präparats beim Abbremsen des kognitiven Verfalls das Risiko von ernsthaften Nebenwirkungen (...) nicht aufwiegt".
Den Neurologen Wenzel Glanz überraschte die Entscheidung: "Wir hatten uns schon auf die Infusionstherapien eingestellt." Auch die Begründung kann der Forscher am DZNE-Standort Magdeburg und leitende Arzt der Gedächtnissprechstunde der Uniklinik Magdeburg nur "bedingt nachvollziehen". "Ödeme und Blutungen gibt es bei etwa 30 Prozent der Behandelten", sagte er der dpa. "Daher erfordert die Therapie ein konstantes Monitoring, zum Beispiel durch regelmässige MRT-Untersuchungen."
Die Hoffnungen vieler Betroffenen und Angehörigen seien zerschlagen worden, betonen die Fachleute. Gabor Petzold, Direktor der Klinischen Forschung am DZNE und Neurologe am Uniklinikum Bonn, erklärt: "Wir verlieren hier die Chance auf eine wertvolle und im Frühstadium der Erkrankung wirksame Therapiemöglichkeit." Das Medikament könne zwar Nebenwirkungen haben. "Diese sind jedoch durch gezielte Voruntersuchungen, um für die Behandlung geeignete Patienten zu identifizieren, sowie regelmässige Kontrolluntersuchungen des Gehirns mittels Magnetresonanztomografie bei den meisten Patienten früh erkennbar und gut beherrschbar", führt Petzold aus.
Eine Zulassung hätte die Möglichkeit eröffnet, die Therapie zunächst auf Patientengruppen zu fokussieren, bei denen ein besonders günstiges Wirkungs-Nebenwirkungsverhältnis von Lecanemab zu erwarten sei, unterstrich auch Johannes Levin, Stellvertretender Leiter der Klinischen Forschung am DZNE München sowie Neurologe am Klinikum der Ludwig-Maximilians-Universität München. "Diese Diskussion kann nun nicht geführt werden." Weiter könnte die Entscheidung das Risiko für eine Zweiklassenmedizin schaffen, da wohlhabende Patienten in Europa das Medikament über internationale Apotheken kaufen und sich damit auf eigene Kosten behandeln lassen könnten, so Levin.
Die Empfehlung der EMA ist notwendig für die Zulassung von Medikamenten in der EU. Das Unternehmen Eisai kündigte bereits an, eine erneute Prüfung für die Zulassung in der EU zu beantragen.
Verwendete Quellen
- Eisai.com: Update on Regulatory Review of Lecanemab for Early Alzheimer’s Disease in the European Union
- Europäische Arzneimitelbehörde: Refusal of the marketing authorisation for Leqembi (lecanemab) (PDF)
- dpa: EU-Behörde lehnt Empfehlung von Alzheimer-Medikament ab
- Deutsches Zentrum für Neurodegenerative Erkrankungen: Experten-Stimmen des DZNE zur "Lecanemab"-Ablehnung durch EU-Arzneimittel-Agentur